Creados óvulos humanos fecundables a partir de células de la piel usando la técnica que clonó a la oveja ‘Dolly’
Este trabajo preliminar abre la puerta a que mujeres infértiles y parejas homosexuales tengan hijos con carga genética propia
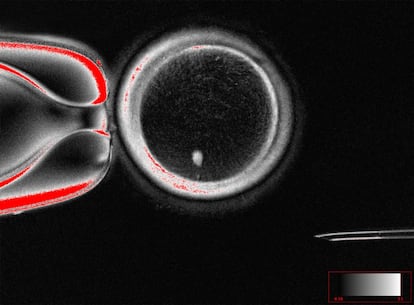

Más del 10% de los nacimientos en España son ya fruto de tratamientos de reproducción asistida. Para muchas mujeres, la principal causa de infertilidad es la ausencia de óvulos que funcionen, sobre todo a partir de los 35 años, cuando la calidad empieza a descender drásticamente. Si las técnicas para estimular la producción de óvulos propios fallan, la única opción es recurrir a óvulos donados, pero eso significa renunciar a tener descendencia con el propio ADN. Hoy, un trabajo liderado por el laboratorio de Shoukhrat Mitalipov, de la Universidad de Salud y Ciencia de Oregón (OHSU), en EE UU, muestra un camino por el que la ciencia puede acabar con esa limitación y abrir la puerta, incluso, a que las parejas homosexuales tengan descendencia con la genética de ambos.
Desde hace años, los científicos buscan alternativas radicales a la reproducción convencional. Una de ellas es la transformación en el laboratorio de células de la piel o la sangre en óvulos o espermatozoides. En ratones, se han producido óvulos y espermatozoides fecundables y que fecundan y dan lugar a ratones, pero en humanos el logro es más difícil.
Uno de los equipos que trabajan en este campo es el liderado por el japonés Mitinori Saitou. Él busca la producción de células reproductivas siguiendo un camino parecido al natural. En primer lugar, reprograman células adultas a través de cuatro genes que consiguen rebobinarlas hasta su estado de células madre pluripotentes, capaces de convertirse en cualquier célula del cuerpo. Después, esas células maleables son transformadas en células germinales primordiales y finalmente en óvulos o espermatozoides. Ese logro final que han alcanzado en ratones, aún no se ha podido reproducir en humanos.
En el estudio que el equipo de Mitalipov y Paula Amato publica hoy en la revista Nature Communications, se presenta un camino alternativo. En lugar de crear un óvulo desde cero, intenta reprogramar una célula de piel adulta para que imite lo que sucede con la meiosis. Ese proceso empieza con una célula normal, con 46 cromosomas, los 23 que heredamos del padre y los 23 de la madre, y genera nuestras propias células reproductivas, óvulos y espermatozoides, que solo tienen 23 cromosomas. En ese proceso, los genes se mezclan como en una baraja y se genera la mitad de la herencia de un nuevo ser que será único.
Lo que demuestra el equipo estadounidense es que es posible inducir una división celular reductiva, como la que sucede en la meiosis, para que la célula de piel, con sus 46 cromosomas, se convierta en un óvulo funcional con 23. En las mujeres, este complejo proceso dura más de una década, desde que comienza cuando aún son un embrión.
Los investigadores emplearon una técnica conocida como Transferencia Nuclear de Células Somáticas (SCNT), la misma que se utiliza para la clonación y que hizo posible la oveja Dolly en 1996. Tomaron el núcleo de una célula de piel, con sus 46 cromosomas, y lo introdujeron en el óvulo de una donante al que antes habían extraído su núcleo. Si ese óvulo se fecundase con un espermatozoide, daría lugar a un embrión con tres pares de cromosomas, inviable. Para evitarlo, indujeron un proceso que bautizaron como mitomeiosis que engaña a la célula para que se divida sin antes haber duplicado su ADN, descartando un par de cromosomas y haciendo que el óvulo sea funcional.
Con este proceso, produjeron 82 ovocitos funcionales que después fertilizaron en el laboratorio. De estos óvulos, solo el 9% se desarrolló hasta los seis días, el punto en el que el embrión se transferiría al útero en un tratamiento de fertilización in vitro, pero en el experimento ya no se continuó con el cultivo y se descartaron.
Prueba de concepto prometedora
El éxito, sin embargo, solo se presenta como una prueba de concepto, como la muestra de que es posible hacerlo, aunque los retos aún son numerosos. Además de que pocos embriones alcanzaron la etapa en la que serían implantables, el proceso dio lugar a embriones con alteraciones por falta o exceso de cromosomas o mosaicos donde algunas células eran normales y otras tenían trisomías.
Nuria Martí, primera autora del estudio, considera que “este nuevo enfoque en el campo de la gametogénesis in vitro es prometedor”, pero reconoce que queda mucho trabajo por delante. “Entre otras cosas, entender cómo se emparejan los cromosomas homólogos para crear ovocitos con el número correcto de cromosomas, forzar la recombinación cromosómica y también el imprinting [las marcas epigenéticas que silencian ciertos genes dependiendo de si vienen del padre o de la madre y hacen que el embrión sea viable]”, explica. “En mi opinión, como mínimo quedan diez años antes de que esta técnica esté lista para estudios clínicos”, calcula.
En unas declaraciones recogidas por el portal especializado Science Media Center, Ying Cheong, profesor de medicina reproductiva de la Universidad de Southampton, opina que, aunque se trata de un trabajo de laboratorio incipiente, “en el futuro podría transformar la forma en que entendemos la infertilidad y, quizá un día, abrir la puerta a crear óvulos o esperma para quienes no tienen otras opciones”. Para Martí, lo más emocionante de este estudio es dar la posibilidad de tener un hijo relacionado genéticamente a personas que no pueden, ya sea “mujeres que no tienen ovocitos, debido a la edad u otras razones, como un tratamiento previo contra el cáncer, […] o que parejas del mismo sexo tengan hijos relacionados genéticamente con ambos padres”.
En 2013, Shoukhrat Mitalipov se convirtió en una estrella mundial de la ciencia cuando anunció que había obtenido células madre embrionarias humanas mediante transferencia nuclear, la misma técnica que ha utilizado ahora. Entonces, su equipo logró reprogramar una célula de piel adulta insertándola en un óvulo al que previamente se le había extraído su núcleo. El óvulo resultante, con el ADN del donante de piel, se activó y desarrolló hasta blastocisto, momento en el que se extrajeron las células madre.
Este éxito demostró su dominio de la técnica SCNT (Transferencia Nuclear de Células Somáticas), la misma base del trabajo publicado hoy. Aquel método había funcionado en varios animales, desde cabras y vacas a macacos, pero nunca lo había hecho en humanos. Entonces, el hallazgo provocó revuelo porque suponía un paso hacia la clonación humana. Mitalipov aclaró que la intención de su trabajo era conseguir células madre para combatir enfermedades en el futuro y negó que su objetivo fuese, algún día, clonar a seres humanos.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.




























































