El primer trasplante de minirriñones humanos en cerdos abre una vía para no desperdiciar miles de órganos donados
El avance puede facilitar la recuperación de vísceras dañadas para reducir las listas de espera de trasplantes, que no dejan de crecer

A pesar de que España es referencia mundial en trasplantes, cada año miles de personas se quedan sin recibir el riñón donado que necesitan. Lo mismo sucede con otros órganos. Y a nivel global el problema es muchísimo más grave, con millones de afectados y unas listas de espera que no dejan de crecer por el envejecimiento de la población. En Estados Unidos, diecisiete personas mueren cada día esperando un riñón trasplantado, y cada nueve minutos se suma un paciente más a la lista de espera. La situación amenaza con colapsar los sistemas de salud dentro de unos años. Hoy, un avance biomédico liderado por investigadores españoles abre una nueva vía para aliviar las listas de espera de trasplantes usando minirriñones humanos.
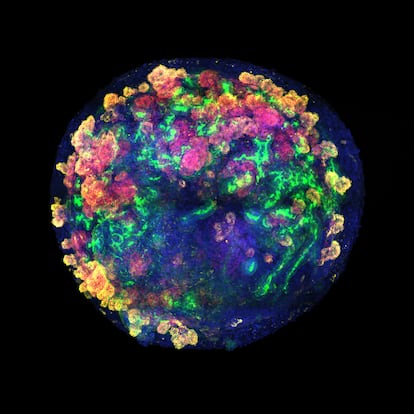
Estos organoides empiezan siendo un amasijo de unas pocas células madre, y después crecen hasta ser unas pelotitas algo más pequeñas que la cabeza de un alfiler. En ese momento ya tienen un armazón de células especializadas que se asemeja al de los diferentes órganos del cuerpo, una característica que los hace ideales para estudiar enfermedades o hacer pruebas de toxicología.
El nuevo trabajo da un salto para explorar si estas estructuras también pueden usarse para trasplantes en humanos. Los investigadores han desarrollado organoides de riñón a partir de células madre humanas, los han cultivado y, por primera vez, han demostrado cómo producirlos en gran cantidad y de forma rentable, lo que acerca su futura aplicación a pacientes.
El trabajo lo ha dirigido la bióloga barcelonesa de 47 años Nuria Montserrat, profesora de investigación ICREA en el Instituto de Bioingeniería de Cataluña (IBEC) hasta hace poco más de un año, y actual consejera de Investigación y Universidades de la Generalitat de Cataluña.
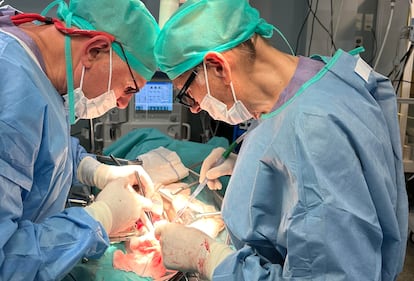
Antes de asumir su cargo en el Gobierno de Salvador Illa, Montserrat llevaba más de una década impulsando el uso de estos cultivos celulares en medicina regenerativa. Ahora, junto a científicos de varias entidades españolas, incluida la Organización Nacional de Trasplantes, e investigadores de la Universidad de California, su equipo ha conseguido injertar por primera vez organoides renales humanos en riñones porcinos gracias a máquinas de perfusión normotérmica, utilizadas habitualmente en el quirófano para mantener el órgano vivo y oxigenado fuera del cuerpo antes de un trasplante. Esta maniobra permite la integración de las células humanas en el órgano del animal. Por primera vez, los investigadores han vuelto a trasplantar estos riñones a los animales vivos a los que se los habían extirpado, y han demostrado su funcionalidad y ausencia de rechazo. El estudio se ha publicado este viernes en la revista especializada Nature Biomedical Engineering.
El paso siguiente, explica Montserrat a EL PAÍS, es ensayar la técnica con vísceras de cadáveres humanos. “Cada año se descartan más de 1.000 riñones que no son aptos para entrar en el proceso de trasplante. Ahora tenemos la oportunidad de usarlos para investigación”. El objetivo final es reducir las listas de espera de trasplantes y aumentar el número de riñones disponibles para su injerto.
Fabricar organoides humanos que valgan para estos usos es complejísimo. “Hace 10 años”, detalla Montserrat, “nuestra idea era hacer un riñón humano entero, desde cero, pero es algo muy naíf”. “El riñón es uno de nuestros órganos más complejos, con 23 tipos de células especializadas diferentes”, añade.
Los nuevos organoides renales son apenas visibles en el momento de integrarse en los órganos de cerdo —deben medir unas 200 micras para poder entrar por las arterias sin obstruirlas— pero ya tienen 19 tipos distintos de células específicas. Gracias a la colaboración con instituciones repartidas por España, que son el armazón de una futura red (desarrollo de miniórganos en Barcelona, experimentos y trasplantes al cerdo en A Coruña usando máquinas de perfusión fabricadas en Zaragoza, y análisis de la respuesta inmune en el Instituto de Salud Carlos III de Madrid), se ha demostrado esta técnica “como prueba de concepto”.
La escasez global de órganos ha impulsado el uso de vísceras de cerdo para trasplantes en humanos. Hasta ahora, uno de los casos más exitosos había sido el de Tim Andrews, un estadounidense de 67 años al que se le injertó un riñón porcino que previamente había sido modificado genéticamente para eliminar virus y hacerlo más compatible con su organismo. La operación fue un éxito hasta hace apenas unos días, cuando los médicos del Hospital General de Massachusetts se lo extirparon porque estaba dando problemas. Andrews vivió 271 días con el implante, un récord mundial. Los dos primeros pacientes que recibieron estos trasplantes murieron poco después de la intervención, y el tercero pudo llevarlo durante 130 días hasta que su organismo lo rechazó. Otros pacientes vivos también han recibido trasplantes experimentales de corazón e hígado de estos animales, aunque su efectividad aún es muy incierta. Por ahora, este tipo de intervenciones se ven como un puente con el que ganar tiempo hasta que llega en órgano humano necesario.
Los organoides humanos se suman ahora como una nueva vía, opina Jordi Ochando, inmunólogo del Carlos III y del Hospital Monte Sinai de Nueva York, y coautor del trabajo. “En muchas ocasiones un paciente no recibe uno, sino varios trasplantes de riñón debido al rechazo. Estas técnicas podrían ayudar a que los injertos sean más compatibles con el paciente y evitar problemas”, explica. Además, estos análogos “se pueden utilizar en riñones humanos que se descartan para trasplantar y aumentar el número de órganos disponibles, pero también se pueden utilizar en riñones de cerdos transgénicos para hacerlos más compatibles con el receptor”, detalla.
Es la primera vez que se producen minirriñones de calidad en grandes cantidades y con una fiabilidad alta, destaca la bioquímica Elena Garreta, coautora del estudio. “Hasta ahora, con los métodos convencionales podías conseguir crear unos 40 tejidos de este tipo. Ahora, gracias a nuestro sistema, podemos fabricar 30.000 en un solo experimento, y además comprobamos que todos son de alta calidad”, señala. Aún quedan años de trabajo por delante, pero este avance abre muchas puertas hacia aplicaciones terapéuticas, opina.
La nefróloga Beatriz-Domínguez-Gil, directora de la Organización de Trasplantes y coautora del trabajo, pinta el escenario de fondo en el que se encuadra esta investigación. “Un día cualquiera, en Europa hay más de 77.000 pacientes esperando un riñón para trasplante, según un estudio reciente en 40 países. Son gente abocada a un largo tratamiento con diálisis, con la disrupción que esto tiene en su desarrollo personal y profesional. Esto se transforma completamente con un trasplante renal, que mejora la esperanza de vida y además es menos costoso que la diálisis. Esta situación se complica con el envejecimiento progresivo de los donantes, que tienen mayor comorbilidad. Esto hace imprescindible buscar soluciones alternativas, y los organoides son una de las posibilidades de futuro”, expone. La directora de la ONT explica que ya existe un acuerdo con hospitales de Barcelona, Madrid, Galicia y Cantabria para empezar a usar órganos humanos descartados en estas investigaciones, previsiblemente el próximo año.
Aunque la aplicación de estos tejidos humanos aún está lejos en el tiempo, opina Domínguez-Gil, la médico vaticina dos usos de esta tecnología: poder extirpar el riñón de una persona con patología renal, tratarlo con un sistema similar al empleado con cerdos y volver a implantarlo; y usar esta técnica para regenerar órganos donados que no cumplen los requisitos para trasplante.
El médico brasileño Leonardo Riella fue el director del equipo que realizó el trasplante de riñón de cerdo al paciente estadounidense en el Hospital General de Massachusetts. El jefe de trasplantes renales y catedrático de la Universidad de Harvard, que no ha participado en este trabajo, lo alaba como un gran primer paso. “Es una prueba de concepto elegante e innovadora que demuestra que los organoides renales humanos pueden sobrevivir e integrarse dentro de riñones porcinos durante un corto período. Es un paso emocionante hacia la fusión de la medicina regenerativa y los xenotrasplantes [de animal a humano]. Los principales desafíos a futuro serán lograr una viabilidad a largo plazo y demostrar una verdadera función renal proveniente de los organoides trasplantados. Si se logra esto último, eventualmente podría conducir a nuevos tratamientos para restaurar la función renal en pacientes con enfermedad renal crónica”, destaca.
Marcos López-Hoyos, jefe de inmunología del Hospital Universitario Marqués de Valdecilla, en Santander, advierte de que estas técnicas aún están en la fase de investigación en animales, pero aún así son “muy interesantes”. “En la actualidad ya se están recuperando riñones con métodos de perfusión ex vivo como los usados en este estudio. Los organoides, aunque no reproducen totalmente un riñón real, sí que son capaces de regenerarlo y tienen unas posibilidades enormes en tratamiento”, destaca.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.
























































